[1] B Hu, H Guo, P Zhou and Z-L Shi, "Characteristics of SARS-COV-2 and COVID-19," Nat Rev Microbiol., United Kingdom, p. 141ŌĆō154, 2021.
[2] J She, J Jiang, L Ye, L Hu, C Bai and Y Song, "2019 novel coronavirus of pneumonia in Wuhan, China: Emerging attack and management strategies," Clin Transl Med., United States, p. 192020.
[3] BS Mohan and N Vinod, "Covid-19: An insight into SARS-cov2 pandemic originated at Wuhan City in Hubei Province of China," J Infect Dis Epidemiol., United States, p. 1462020.
[4] E Vivier, E Tomasello, M Baratin, T Walzer and S Ugolini, "Functions of Natural Killer Cells," Nat Immunol., United Kingdom, p. 503ŌĆō10, 2008.
[5] AJ Lee, SG Kim, CH Jeon, HS Suh, GS Yoon and AN Seo, "A case of natural killer cell leukemia misdiagnosed as tuberculous lymphadenopathy," Korean J Lab Med., Korea, p. 194ŌĆō198, 2009.
[6] S Anguille, HH Van Acker, J Van den Bergh, Y Willemen, H Goossens, VF Van Tendeloo, EL Smits, ZN Berneman and E Lion, "Interleukin-15 Dendritic Cells Harness NK Cell Cytotoxic Effector Function in a Contact-and IL-15-Dependent Manner," PLoS One., United States. pp. e01233402015.


[7] P Carrillo-Bustamante, C Ke┼¤mir and RJ de Boer, "The evolution of natural killer cell receptors," Immunogenetics., Germany, p. 3ŌĆō18, 2016.
[8] R Kapur, DL Evans and DT Harris, "An evolutionary conserved target cell antigen along with MHC class I molecules influences susceptibility to murine NK cell lysis," Dev Comp Immunol., United Kingdom, p. 347ŌĆō55, 1995.
[9] S Kumar, "Natural killer cell cytotoxicity and its regulation by inhibitory receptors," Immunology., United Kingdom, p. 383ŌĆō393, 2018.
[10] NK Bj├Črkstr├Čm, B Strunz and HG Ljunggren, "Natural killer cells in antiviral immunity," Nat Rev Immunol., United Kingdom, p. 112ŌĆō123, 2022.
[11] MT Orr and LL Lanier, "Natural killer cell education and tolerance," Cell., United States, pp. 847ŌĆō856, 2010.


[13] AY Mah and MA Cooper, "Metabolic Regulation of Natural Killer Cell IFN-╬│ Production," Crit Rev Immunol., United States, p. 131ŌĆō147, 2016.
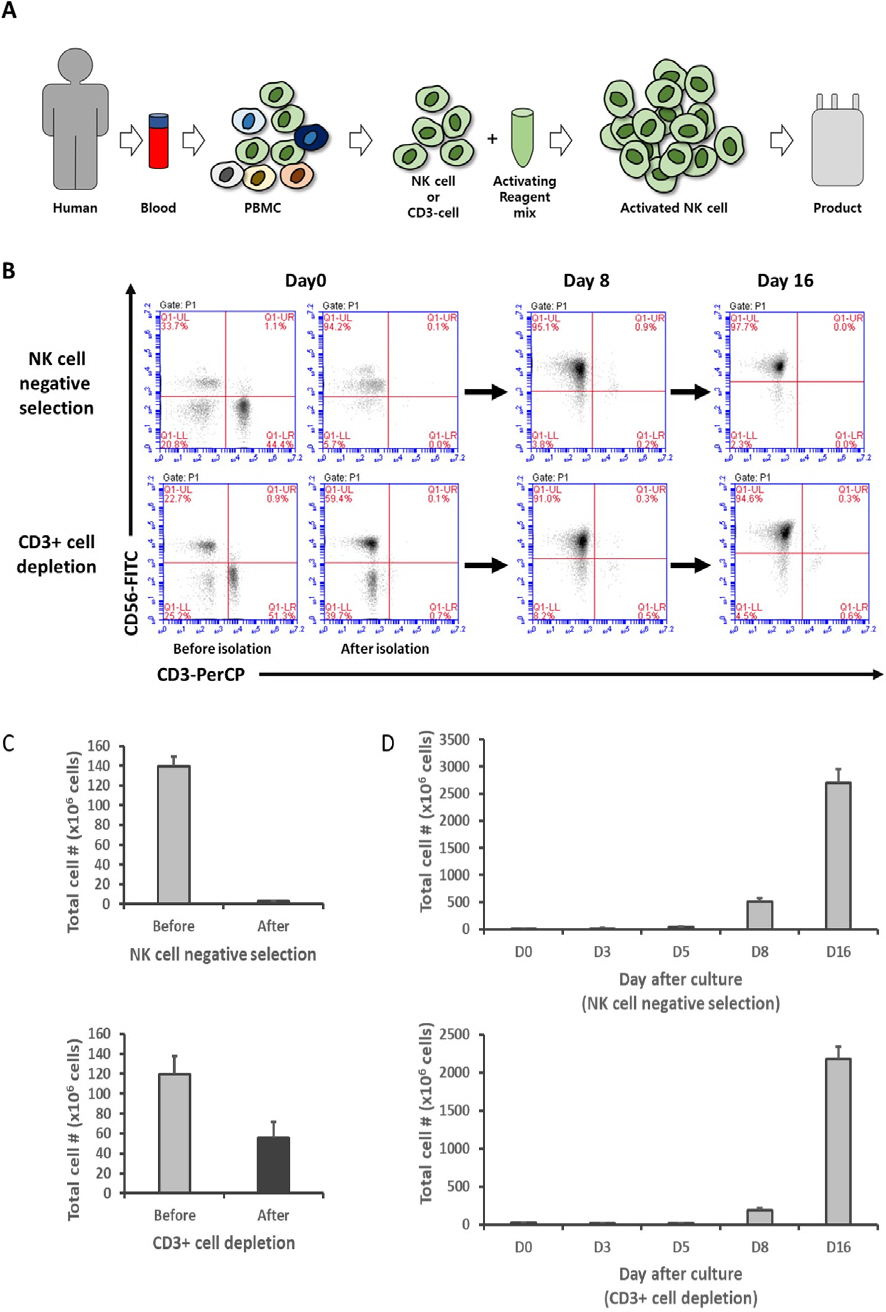
[14] SS Somanchi, VV Senyukov, CJ Denman and DA Lee, "Expansion, purification, and functional assessment of human peripheral blood NK cells," J Vis Exp., United States, p. 25402011.
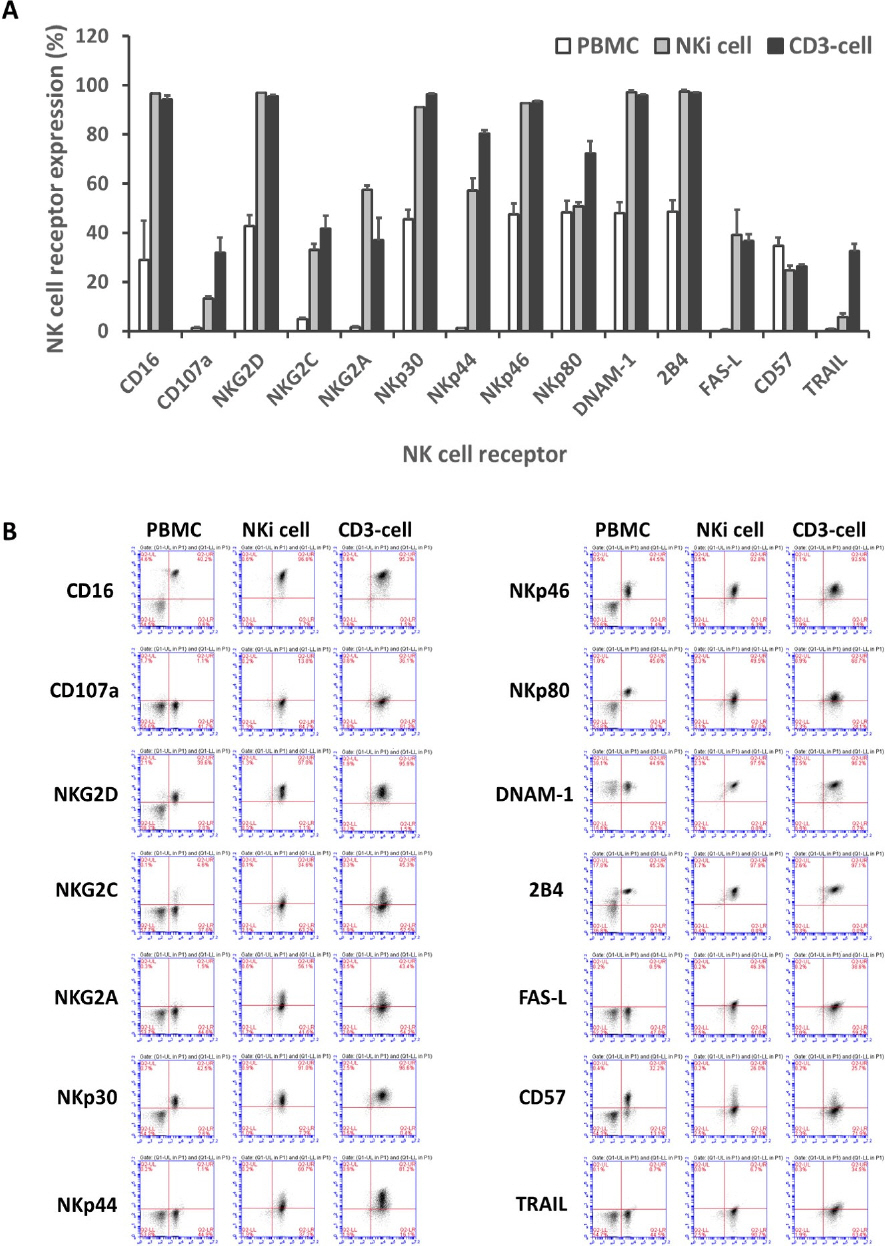
[15] T Nakazawa, T Morimoto, R Maeoka, R Matsuda, M Nakamura, F Nishimura, S Yamada, I Nakagawa, YS Park, H Nakase and T Tsujimura, "Establishment of an efficient ex vivo expansion strategy for human natural killer cells stimulated by defined cytokine cocktail and antibodies against natural killer cell activating receptors," Regen Ther., Japan. pp. 185ŌĆō191, 2022.


[16] Y Tanaka, T Nakazawa, M Nakamura, F Nishimura, R Matsuda, K Omoto, Y Shida, T Murakami, I Nakagawa, Y Motoyama, H Morita, T Tsujimura and H Nakase, "Ex vivo-expanded highly purified natural killer cells in combination with temozolomide induce antitumor effects in human glioblastoma cells in vitro," PLoS One., United States, pp. e02124552019.


[18] DS Bae and JK Lee, Development of NK cell expansion methods using feeder cells from human myelogenous leukemia cell line, Blood Res., South Korea. pp. 154ŌĆō61, 2014.
[19] A Zafarani, MH Razizadeh, S Pashangzadeh, Amirzarga MRr, M Taghavi-Farahabadi and M Mahmoudi, "Natural killer cells in COVID-19: from infection, to vaccination and therapy," Future Virol., England. 2023.


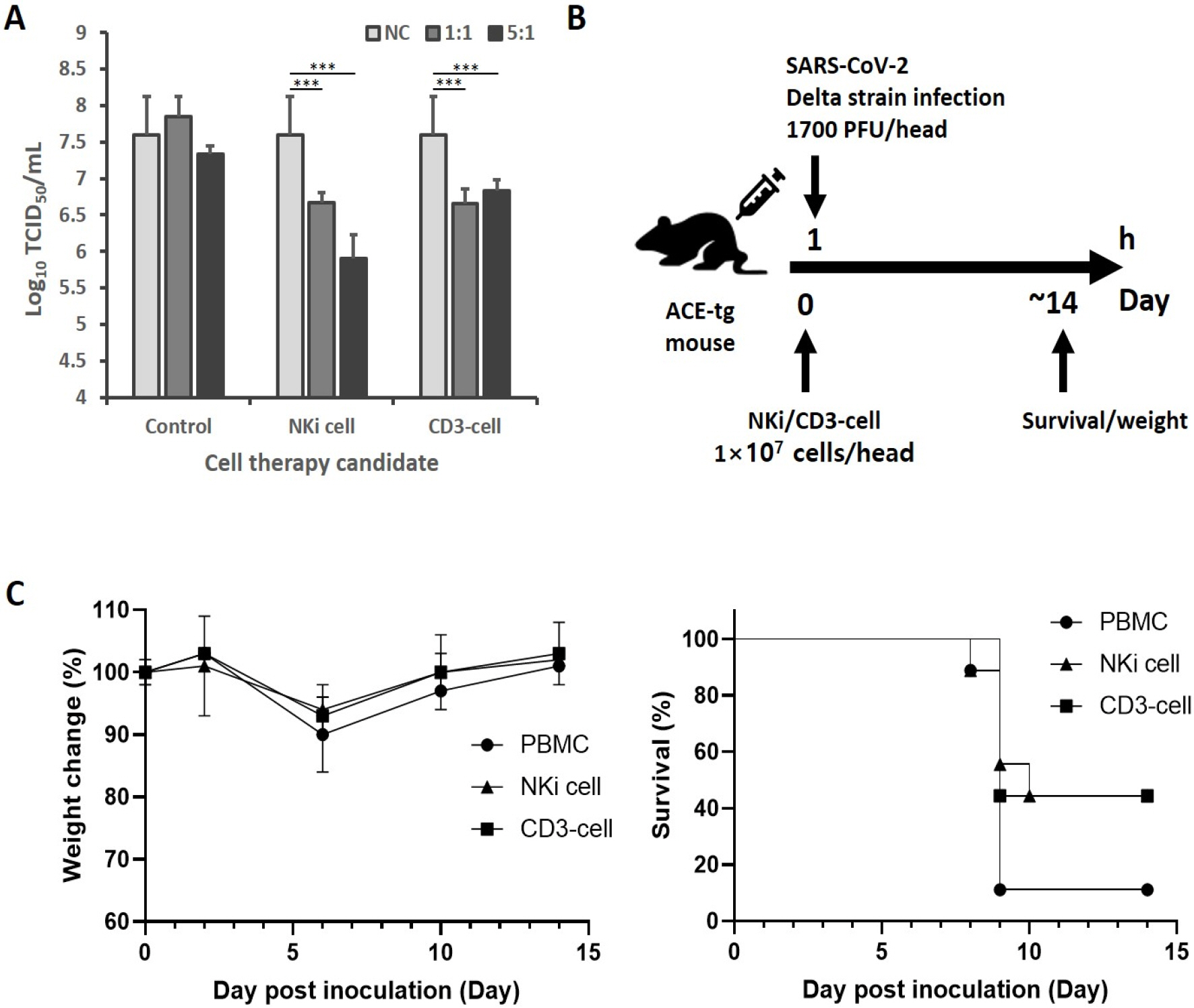
[20] H Kim, JE Byun, SR Yoon, H Koohy, H Jung and I Choi, "SARS-CoV-2 peptides bind to NKG2D and increase NK cell activity," Cell Immunol., United States, p. 1044542022.
[21] C Di Vito, F Calcaterra, N Coianiz, S Terzoli, A Voza, J Mikulak, S Della Bella and D Mavilio, "Natural Killer Cells in SARS-CoV-2 Infection: Pathophysiology and Therapeutic Implications," Front Immunol., Switzerland. pp. 8882482022.
[22] C Capuano, C Pighi, S Battella, D De Federicis, R Galandrini and G Palmieri, "Harnessing Cd16- Mediated Nk Cell Functions to Enhance Therapeutic Efficacy of Tumor-Targeting Mabs.," Cancers(Basel), Switzerland, 2021.
[23] AM Pituch-Noworolska, "NK cells in SARS-CoV-2 infection," Cent Eur J Immunol., Poland, p. 95ŌĆō101, 2022.
[24] SR Wiley, K Schooley, PJ Smolak, WS Din, CP Huang, JK Nicholl et al, "Identification and Characterization of a New Member of the Tnf Family That Induces Apoptosis," Immunity, United States, pp. 673ŌĆō682, 1995.


[25] NK Bjorkstrom, P Riese, F Heuts, S Andersson, C Fauriat, MA Ivarsson, AT Bjorklund, MF Tullberg, J Michaelsson, ME Rottenberg, CA Guzman, HG Ljunggren and KJ Malmberg, "Expression patterns of NKG2A, KIR, and CD57 define a process of CD56dim NK-cell differentiation uncoupled from NK-cell education," Blood, United States, pp. 3853ŌĆō3864, 2010.
[26] H Zhang, JM Penninger, Y Li, N Zhong and AS Slutsky, "Angiotensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: molecular mechanisms and potential therapeutic target," Intensive Care Med., United States, p. 586ŌĆō590, 2020.
[27] X Deng, H Terunuma and M Nieda, "Exploring the Utility of NK Cells in COVID-19," Biomedicines, Switzerland, p. 10022022.