서 론
리신 독소(RTx, 576 amino acid)는 파자마 씨에서 추출한 family of type II ribosomal inactivate proteins(RIPs) 로 높은 치사율을 보이는 독소이다[1]. 단백질의 크기는 64 kDa로, signal peptide(1-35 residues of RT), A 사슬(RTA, 36-302 residues of RTx), linker(303-314 residues of RTx), B 사슬(RTB, 315-576 residues of RTx)으로 구성되어있다[2]. RTA는 진핵생물의 리보솜(ribosome)인 28S rRNA에서 광범위하게 보존되어 되어있는 sarcin-ricin loop의 아데노신 부위를 비가역적으로 가수분해 시킨다. RTB는 세포 표면에 있는 당단백질에 결합하여 리신 독소가 세포 내부로 들어갈 수 있도록 유도한다[3]. 리신 독소는 리보솜으로부터 단백질 합성을 억제하여 독성을 나타내는데, 일반적으로 흡입, 주사, 섭취에 의해 중독된다. 인간에서 추정되는 리신 독소의 치사량은 1-10 μg/kg인데, 높은 독성과 대량생산이 가능하여 잠재적인 생물위협 물질로 취급되고 있다[4].
기존의 연구에서 RTA의 활성부위로 Y80, Y123, E177, R180, N209 그리고 W211이 관여되어 있음이 밝혀진 바 있으며, 활성부위와는 별개로 RTA의 74-76 residues가 vascular leak syndrome(VLS)을 일으키는 것으로 알려져 있다[6,8,22]. 기존의 연구들에서 리신 백신의 후보물질로 탈당화된(deglycosylated) RTA 또는 포름알데이드로 불활성화된 리신 톡소이드를 사용했으나, 생독소에 비해 독성이 약해졌음에도 불구하고 동물시험에서 vascular leak syndrome과 같은 부작용이 관찰되어 개발이 중단되었다[4-7]. RiVax는 RTA의 재조합 백신으로 V76M, Y80A 변이를 통해 활성 부위를 변형시킴으로써 독성을 제거했다[8]. RiVax는 임상 1상 시험이 진행중일 뿐만 아니라, 백신을 투여한 영장류(rhesus macaques)에서 리신 흡입 노출을 성공적으로 방어하는 등 활발하게 연구가 진행되고 있다. RVEc는 truncated version으로 RTA의 소수성 도메인을 제거하여 1-33 잔기와 44-198 잔기만을 가지고 있다[9]. 기존의 연구결과에 의하면 RiVax와 RVEc 모두 10×LD50의 리신 독소에 대하여 방어능이 있음을 마우스에서 확인한 바 있다[8-11].
백신에 의한 면역체계의 반응을 증가시키는 물질을 보조제(adjuvants)라고 하며 Toll-like receptor(TLR) 신호전달 체계에 영향을 미치는 유무에 따라 두 개의 그룹으로 나눌 수 있다[12,13]. Aluminum hydroxide와 aluminum phosphate는 대표적인 TLR 독립 보조제로 정확한 메커니즘은 불분명하지만 상용화된 백신에서 가장 널리 사용되는 보조제이다[14,15]. TLR은 병원체가 특이적으로 보유한 병원체 연관 분자 패턴(pathogen associated molecular pattern)을 인지하여 면역반응을 자극하는 수용체이다[16]. TLR4는 그람 음성 박테리아의 외막에서 발견되는 지질다당류(lipopolysaccharides, LPS)를 인지하며, TLR5는 flagellin을, TLR7/8은 poly-U 또는 GU-rich 서열이 포함된 단일 가닥 RNA(single stranded RNA, ssRNA)를, TLR9은 메틸화되지 않은(unmethylated) CpG motifs를 인지한다[13,17-21].
본 논문에는 리신 독소의 구조를 분석하여 독성 활성을 제거한 리신 백신 개발 및 독성 평가 결과에 대한 내용을 서술했다. 또한 리신 백신에 최적화된 보조제 선별에 관한 내용과 리신 독소에 대한 최대 방어능, 그리고 리신 백신 투여 기간의 단축에 관한 시험과 그 결과를 정리했다.
실험방법
리신 백신(R51)은 pET28a 발현벡터에 제한효소 Nde I과 Not I을 사용하여 삽입한 뒤 Escherichia coli strain BL21(DE3)에 형질전환시키고 Luria-Bertani(LB) 배지 (1 % tryptone, 0.5 % yeast extract, 1 % NaCl)에 Kanamycin을 100 μg/ml의 농도로 첨가하여 형질전환된 후보군을 선별했다. 대장균으로부터 단백질 발현을 확인하기 위해 37 °C에서 배양한 후 OD600이 0.4일 때 isopropylthiogalactoside(IPTG)를 0.5 mM 농도로 첨가한 후 25 °C에서 12시간 동안 추가 배양한다. 배양한 대장균은 원심분리하여 세포만 획득한 후 Lysis buffer (20 mM TRIS-Cl pH 8.0, 200 mM NaCl)에 현탁시킨 후 초음파 파쇄기를 통해 세포를 용해시켰다. 용해물은 Ni-NTA 컬럼을 이용하여 1차 정제를 진행하고 thrombin을 처리하여 히스티딘을 제거한 후 size-exclusion chromatography를 이용해 2차 정제를 진행했다.
리신 백신의 in vitro 세포독성을 확인하기 위해 RPMI 배지(10 % FBS, 1 % Penicillin/Streptomycin)에서 배양한 Jurkat 세포를 2×104 cells/well로 96 well plate에 준비했다. RTA 또는 R51을 0.2 - 10,000 ng/ml 농도로 처리한 후 24시간 동안 37 °C에서 배양했다. 이후 WST-1을 처리한 후 37 °C에서 2시간 배양하고 450 nm에서 흡광도 측정을 통해 세포독성을 관찰했다. 리신 백신의 in vivo 독성을 관찰하기 위해 R51을 근육주사로 투여한 후 생존율을 14일간 관찰했다.
보조제에 따른 리신 백신의 효능을 관찰하기 위해 6주령 female ICR 마우스에 1 μg/head의 R51을 보조제와 혼합한 후 100 μl 용량으로 3주 간격으로 3회 근육주사 투여했다. 보조제는 Phosphate buffered saline (PBS)를 완충용액으로 하여 Aluminum hydroxide(Al), Imiquimod(Im), Flagellin(Fl), CpG oligodeoxynucleotide (ODN), Monophosphoryl lipid(MPL) 또는 Aluminum phosphate(Al-phos)를 제조사 메뉴얼에 따라 첨가했다(Table 1). 마지막 백신 투여 2주 후 채혈하여 리신에 결합하는 항체가 측정을 수행하고 리신 독소를 근육주사로 투여한 후 2주간 생존율을 관찰했다. 최대 방어능 및 투여기간 단축 시험은 PBS를 완충용액으로 하여 5 μg의 R51을 100 μg의 aluminum hydroxide와 혼합한 후 근육주사로 투여했다.
Table 1.
Adjuvants and their concentrations
| Adjuvants | Stock dose | Working dose |
|---|---|---|
| Al | 2 % | 0.2 % |
| Im | 1.0 μg/μl | 10 μg/100 μl |
| Fl | 0.5 μg/μl | 1.0 μg/100 μl |
| ODN | 2.0 μg/μl | 20 μg/100 μl |
| MPL | 1.0 μg/μl | 2.0 μg/100 μl |
| Al-phos | 5.0 μg/μl | 50 μg/100 μl |
리신 항체가 측정은 리신 독소를 0.05M carbonate-bicarbonate pH 9.6 완충용액에 2 μg/ml의 농도로 희석한 후 96 well 플레이트에 50 μl씩 분주하고 4 °C에서 16시간 반응시켰다. 완충용액을 제거한 후 PBST(PBS 에 0.05 % Tween-20)로 300 μl씩 3회 세척하고 blocking buffer(PBST에 5 % skim milk)로 blocking을 37 °C에서 1시간 진행했다. 마우스 혈액으로부터 얻어진 혈청을 적정량 blocking buffer에 희석한 후 blocking 된 96 well 플레이트에 처리해 주고 37 °C에서 1시간 반응시킨 후 PBST로 3회 세척했다. Anti-mouse IgG HRP를 blocking buffer에 1:10,000으로 희석한 후 37 °C에서 1시간 반응시키고 PBST로 3회 세척했다. 발색은 0.05M phosphate-citrate pH 5.0 완충용액에 O-phenylenediamine dihydrochloride와 urea hydrogen peroxide가 0.4 mg/ml이 되도록 녹인 후 well 당 100 μl씩 분주한 후 실온에서 30분간 암반응시켰다. 각 well에 3M sulfuric acid를 50 μl씩 첨가하여 발색을 정지시키고 492 nm에서 흡광도를 측정하여 항체가 측정을 완료했다.
모든 동물실험은 국립연구협의회 실험동물 관리 및 사용지침(IACUC, Korea, ADD-IACUC-22-02)에 따라 수행했으며 21∼23 °C에서 물과 음식에 접근할 수 있는 환경에서 12시간 밤낮 주기로 사육되었다.
통계적 유의성은 일원배치분산분석(one-way analysis of variance, ANOVA)으로 비교했으며 p<0.05일때 통계적으로 유의한 것으로 판단했다.
결 과
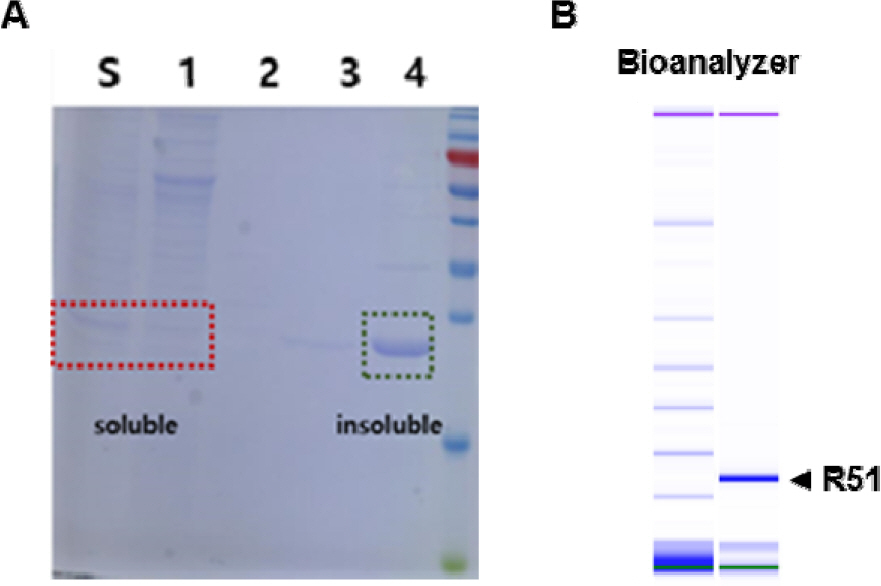
리신 백신 설계를 위해 RTA의 삼차원 구조를 분석하여 아스파라긴 75번(D75)과 타이로신 80번(Y80)을 이황화 결합 가능 부위로 예측하여 백신 구조를 모델링했다. RTA의 D75는 VLS를 일으키는 것으로 알려진 부위이고 Y80은 아데노신 가수분해를 일으키는 활성부위로 알려져 있다. 각 부위를 시스테인으로 치환시켜 이황화 결합을 유도함으로써 단백질의 독성을 제거하는 것으로 설계했다(Fig. 1). R51의 발현 분석 결과 배양 상층액(Fig. 2A, S)과 세포 파쇄 상층액(Fig. 2A, 1)에서 R51의 발현을 관찰 할 수 있었고 불용성의 형태 또한 관찰되었다(Fig. 2A, 4). 세포 파쇠 상층액으로부터 Ni-NTA 컬럼을 이용해 1차 정제를 진행하고 thrombin을 처리하여 히스티딘을 제거한 후 size-exclusion chromatography를 이용해 2차 정제를 진행함으로써 R51을 정제했다. 정제한 R51은 bioanalyzer로 순도를 측정했다(Fig. 2B).
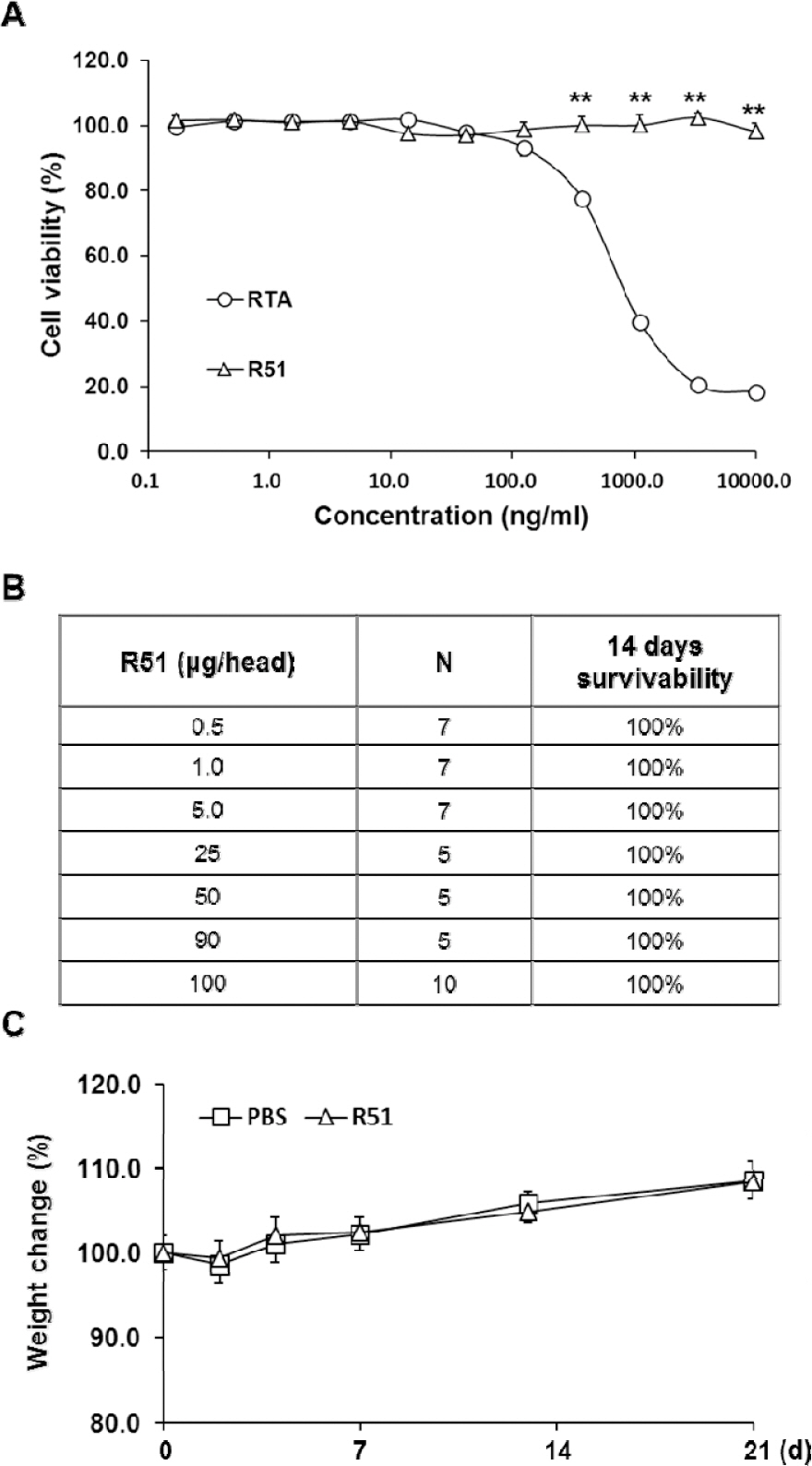
제작한 R51이 예상과 같이 세포독성을 나타내지 않는지 확인하기 위해 Jurkat 세포주 및 WST-1을 활용하여 독성 평가를 수행했다. RTA 또는 R51을 세포에 0.2 ng/ml부터 10 μg/ml까지의 농도로 처리해 준 결과 RTA는 0.37 μg/ml에서 세포 생존율이 77.5±2.2 %로 감소하여 유의미하게 세포 독성을 나타내기 시작했으나 R51은 같은 농도에서 100.2±2.6 %로 독성을 나타내지 않았다. 또한 R51은 최대 농도인 10 μg/ml에서도 생존율이 98.2±2.5 %로 독성을 나타내지 않았다(Fig. 3A). 제작한 백신의 in vivo 독성을 관찰하기 위해 ICR 마우스에 근육주사로 R51을 투여하고 2주간 생존율을 관찰한 결과 100 % 생존함을 확인했다(Fig. 3B). 또한 R51을 최고농도인 100 μg/head로 단회투여 후 3주간 체중 변화를 관찰했을 때 PBS를 투여한 대조군과 차이를 보이지 않았다(Fig. 3C).
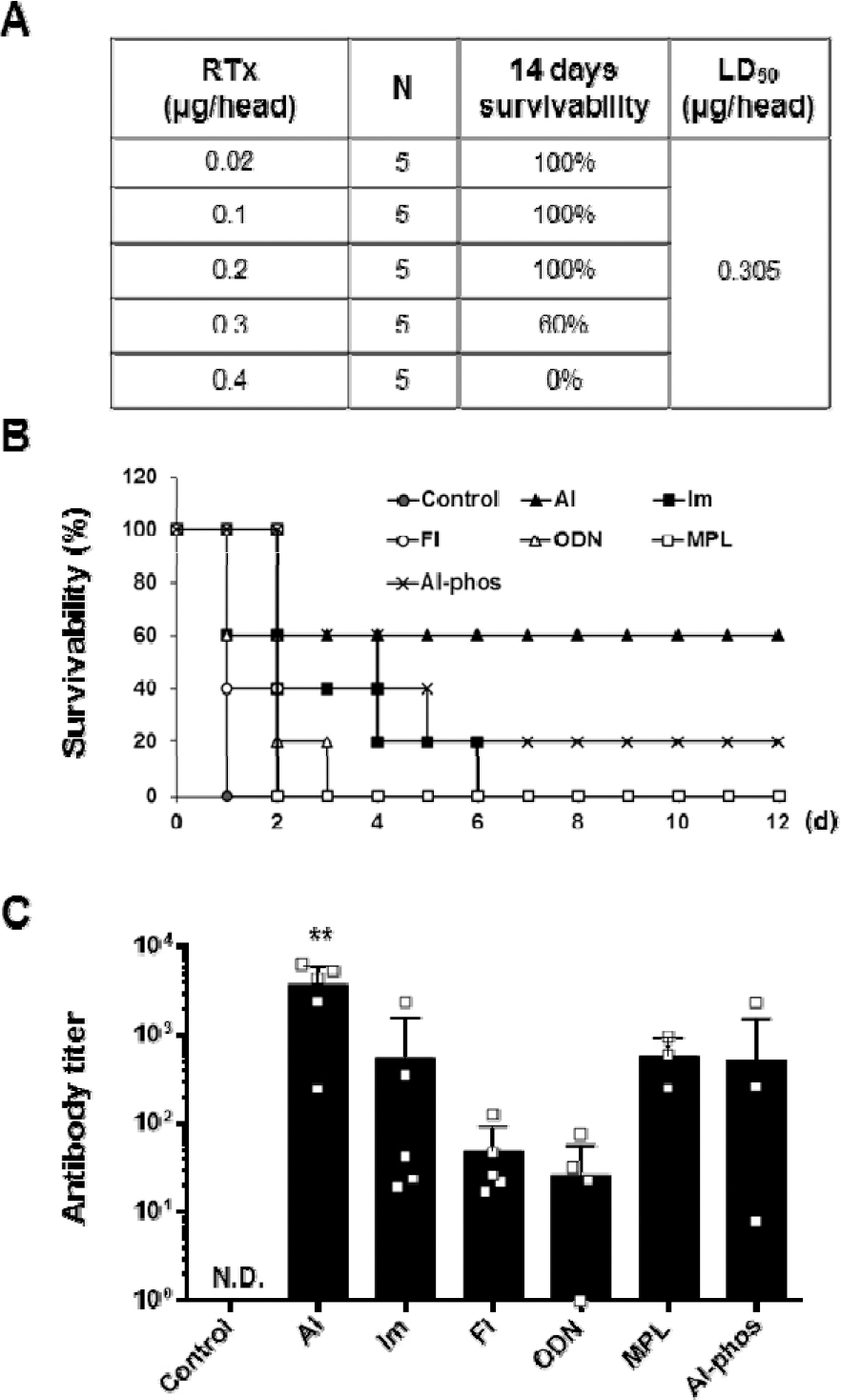
리신 백신 효능 평가를 위해 리신 독소의 반수 치사량(LD50) 산정 시험을 수행한 결과 0.305 μg/head임을 확인했다(Fig. 4A)[23]. 리신 백신에 최적화된 보조제 선별을 위해 기존 논문에서 RiVax 보조제로 사용한 aluminum hydroxide를 포함하여 6종의 보조제에 따른 R51의 효능 평가를 실시했다[10]. 보조제의 농도는 제조사의 권장 농도로 하여 Table 1에 따라 PBS에 혼합했으며 R51은 1 μg/head의 농도로 3주 간격으로 3회 근육 투여했다. 마지막 투여 후 2주 뒤 채혈 및 20×LD50(6.1 μg/head)의 리신 독소로 공격하고 2주간 생존율을 관찰했다. 백신 비투여군의 모든 마우스는 1일 이내에 100 % 죽었으며 알루미늄 계열인 aluminum hydroxide나 aluminium phosphate를 보조제로 사용했을 때 생존율은 각각 60 %, 20 %로 관찰되었다(Fig. 4B). 반면 TLR agonist 보조제의 생존율은 7일 이후 모두 0 %였다. 항체가 측정 결과 Al군이 가장 높은 3730±1089로 관찰되었으며 Im, MPL, Al-phos군은 각각 564±459, 595±198, 522±458로 관찰되었다(Fig. 4C). 항체가가 가장 낮았던 Fl, ODN군은 각각 47±20, 26±14로 관찰되었다. 측정치를 이용하여 ANOVA 분석 결과 p<0.05로 보조제별 유의미한 차이를 보였으며 추가분석에서 Al 군이 모든 보조제들과 비교했을 때 유의미한 차이를 나타내는 것을 확인했다. 본 시험에서는 보조제에 따른 효능의 차이를 관찰하기 위해 기존 문헌에서 사용한 백신의 용량(10 μg/head)보다 낮은 용량(1 μg/head)으로 면역화를 진행하여 백신 투여군의 생존율이 100 %로 포화 되지 않는 조건에서 생존율 측정을 수행했다[10]. 또한 해당 문헌에 기술되어 있지는 않으나 aluminum hydroxide를 보조제로 사용했을 때 리신 백신의 효능이 뛰어났기 때문에 이를 보조제로 사용했을 가능성이 있다[10].
Fig. 4.
Survival rate and antibody titer of R51 vaccine according to adjuvants. N.D., not detected. ** p<0.01.
개발한 리신 백신의 리신 독소에 대한 최대 방어능 확인을 위해 ICR 마우스에 백신 5 μg과 aluminum hydoxide 100 μg을 100 μl PBS에 혼합한 후 3주 간격으로 3회 근육 투여하여 면역화를 진행했으며, 마지막 백신 투여 2주 뒤 혈액 채취 및 20-50×LD50(6.1-15.3 μg/head)의 농도로 리신 독소 공격을 진행했다. 공격 결과 20×LD50의 농도로 공격한 대조군은 이틀이내에 생존율이 0 %였으며 면역화한 ICR 마우스를 20×LD50과 30×LD50(9.2 μg/head)의 농도로 리신 공격을 했을 때 100 % 생존율을 관찰할 수 있었다(Fig. 5A). 가장 높은 농도인 50×LD50(15.3 μg/head)의 독소를 투여했을 때 생존율은 86 %였다. 투여군 간 항체 형성에 차이가 있었는지를 확인하기 위해 항체가를 분석한 결과 낮은 농도의 독소 투여군부터 각각 2013±405, 2410±815 그리고 1207±284로 50×LD50의 독소 투여군에서 다소 낮은 항체가를 보였으나 유의미한 수준은 아니었다(Fig. 5B).
리신 백신의 투여기간 단축 가능성을 관찰하기 위해 0, 1, 3주 백신 투여군(R51 013)과 0, 2, 4주 백신 투여군(R51 024), 그리고 0, 3, 6주 투여군(R51 036)의 항체가 및 20×LD50 리신 방어능을 관찰했다. ICR 마우스에 5 μg/head의 농도로 근육투여를 진행했으며 마지막 백신 투여 후 2주 뒤 혈액채취 및 20×LD50의 리신 독소 공격을 진행한 결과 백신 투여군 별 항체가는 R51 013, R51 024, R51 036 순서대로 각각 1062±436, 2917±714, 2013±405로 유의미한 차이를 보이지 않았다(Fig. 6B). 백신을 투여한 마우스에 20×LD50으로 리신 독소 공격을 했을 때 백신 비투여군은 1일차 생존율이 25 %, 2일차에 모두 죽었으나 모든 백신 투여군은 100 % 생존하는 것을 확인했다(Fig. 6A).
결 론
본 연구에서는 리신 독소의 구조를 분석하여 독성 활성을 제거한 리신 백신을 개발했다. R51을 순수정제하여 보조제 별 리신 독소에 대한 방어능을 비교 한 결과 aluminum hydroxide를 보조제로 사용했을 때 가장 뛰어난 백신 효능을 보였다. 또한 aluminum hydroxide를 보조제로 사용하여 리신 백신을 투여한 ICR 마우스의 리신 독소에 대한 방어능은 30×LD50에서 100 %로 관찰되었으며 50×LD50에서는 86 %로 관찰했다. 백신의 투여 기간을 6주 동안 3회 투여에서 3주 동안 3회 투여로 투여 기간을 단축시켰을 때 백신의 효능은 감소하지 않는 것으로 확인했다. 본 연구로부터 개발한 리신 백신은 향후 비임상 독성평가등 안전성 평가를 거쳐 임상 시험을 진행 할 수 있을 것으로 기대한다.